Články » Oxid uhličitý - formy, distribuce, přidávání 
Oxid uhličitý - formy, distribuce, přidávání
V dnešní době módní a čím dál více využívané hnojení rostlin pomocí oxidu uhličitého (dále jako CO2) se rozšířilo natolik, že se často dostává do rukou začátečníků a běžných společenských nádržích s minimem rostlin. Na internetu je spoustu článků na výrobu a dávkování CO2, rozšířených mýtů a polopravd o jeho aplikaci. Ti, co ho s úspěchem aplikují se zde asi nic nového nedozví a většina částí není určena ani naprostým začátečníkům. Je zde spíše spoustu zajímavostí z fyziologie a morfologie vodních rostlin (až druhý díl) a až v závěru tohoto článku jsou upotřebení pro akvaristiku a samotné pěstování rostlin.
Proč je CO2 a jeho příjem tak důležitý, že se tak masivně jeho přidávání v posledních letech rozšířilo? Hlavním důvodem je pro rostliny velká důležitost uhlíku (C), který je jeho součástí a jeho nedostatečné množství ve vodě.
1. Omezení příjmu CO2
Jak bylo napsáno, uhlík (C) je jedna z nejdůležitějších živin potřebný pro zdárný růst rostlin. Patří mezi biogenní prvky sloužící jako základní kámen všech organických molekul. Jeho koncentrace v sušině rostlin je asi 45 %. Vodní rostliny jsou taxonomicky nejednotná skupina, ale vlivem uniformity vodního prostředí vytvořila ekologickou skupinu vyznačující se podobnými anatomickými a funkčními adaptacemi pro jeho příjem.
Hlavním zdrojem uhlíku pro většinu rostlin je CO2 obsažený v atmosféře v současnosti v přibližně 0,036 % při parciálním tlaku 30 Pa. Za těchto podmínek se při 10 °C v destilované vodě rozpustí 0,7 mg/l a při 25 °C 0,44 mg/l. Koncentrace rozpuštěných plynů ve vodě (a tedy i CO2) je jiná než ve vzduchu a závisí na pH a teplotě. Zatímco v atmosféře je množství oxidu uhličitého relativně stálé. Ponořené rostliny jsou vystaveny výkyvům jeho koncentrace i naprostému nedostatku. Difúze plynů je ve vodě podstatně pomalejší než ve vzduchu, v případě CO2 asi o 4 řády, a také rychlost proudění je nižší. Výměna CO2 je tedy omezená a vznikají tak značné rozdíly koncentrací v různých místech vodního sloupce. Tyto místní rozdíly, ale také změny v průběhu dne či roku, jsou do značné míry způsobeny činností organismů, které ho při fotosyntéze přijímají a při respiraci a rozkladných procesech uvolňují. V půdním vzduchu se takto zvýší parciální tlak CO2 na 0,5-10 kPa, což odpovídá koncentraci rozpuštěného volného CO2 o 7-140 mg/l (25 °C). Zatímco u dna s množstvím rozkládajícího se organického materiálu bývá koncentrace CO2 až několikanásobně vyšší než by odpovídala rovnováze se vzduchem, tak v hustých porostech vodních makrofyt nebo ve volné vodě s vysokou biomasou fytoplanktonu může za slunných dnů vlivem fotosyntézy dojít až k vyčerpání CO2. Zvláště citelný je pak nedostatek CO2 v mělkých eutrofních vodách, kde vlivem nadbytku (fosforu a dusíku), dochází k masivnímu rozvoji vodních vegetace. Dalším omezením příjmu oxidu uhličitého je přítomnost tzv. nemíchané hraniční vrstvy, jejíž tloušťka se pohybuje v od 500 µm v nemíchané vodě do 10 µm v dobře cirkulující. V dobře míchaném prostředí se tedy snižuje, ale nikdy není nulová. Hraniční vrstva se vyskytuje i u suchozemských rostlin, ale její tloušťka je menší a difúze ve vzduchu je podstatně rychlejší. V této nemíchané vrstvě se CO2 může pohybovat pouze difúzí. To zpomaluje zásobení buněk CO2 a omezuje tím rychlost fotosyntézy. Ovšem přináší i výhody a tou je zadržování CO2 vznikajícího respirací. Míra refixace se může u některých rostlin pohybovat i přes 50 % (Isoetidy). U vodních rostlin se vyvinula různá přizpůsobení pomáhající jim vyrovnat se s výkyvům v koncentracích CO2, ale i přes to vlivem jeho nedostatku probíhá fotosyntéza 5-10krát pomaleji než u suchozemských rostlin.
2. Formy výskytu ve vodách a uhličitanová rovnováha
Anorganické sloučeniny uhlíku se ve vodě vyskytují ve dvou základních formách: volné a vázané. (Kincl, Krpeš 2000) Ve volné jako molekulární oxid uhličitý a kyselina uhličitá (H2CO3-) a vázané (iontové) ve formě hydrogenuhličitanu (HCO3- ) a uhličitanu (CO32-). Ve vodě se CO2 snadno rozpouští a přitom se asi z méně než z 1% slučuje (hydratuje) s vodou a vzniká kyselina uhličitá, čistá kys. uhličitá není známa a vždy se rozkládá na CO2 a vodu. Hydratace CO2 s vodou je velmi pomalá a koncentrace oproti molekulárnímu CO2 je zanedbatelná.
CO2 + H2O ↔ H2CO3
Jelikož se příjem CO2 a H2CO3 rostlinami nedá odlišit, mluvíme o tzv. celkovém volném oxidu uhličitém (CO2*). Suma těchto všech forem se nazývá celkový anorganický uhlík (CT). Mezi těmito formami je těsný vztah vzhledem k pH a vytvářejí tak pufrační systém, v přírodě nejrozšířenější a nejúčinnější. Dochází k plně reverzibilním reakcím.
H2CO3 ↔ H+ + HCO3-
HCO3- ↔ H+ + CO32-
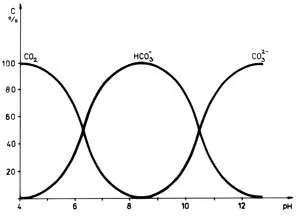
Zastoupení forem závisí na pH, zatímco v kyselém prostředí převládá volný CO2*, se zvyšujícím se pH jeho koncentrace klesá (10× na jednotku pH) a od pH 6,38 začíná převažovat hydrogenuhličitan a to až do pH 10,38 a od této hodnoty převažuje uhličitan. Do vodního prostředí se CO2 dostává pomocí difúze z atmosféry přes vodní hladinu, rozkladem organického materiálu, dýcháním organismů a na oxid uhličitý bohatými výrony podzemní vody. Ve vodě je dobře rozpustný, ale se stoupající teplotou jeho rozpustnost klesá (a varem ho lze úplně odstranit). V běžných vodách se nevyskytuje více jak 0,04-1 mg/l. Když při fotosyntéze není dostatečný přísun CO2 a to se vyčerpá pH stoupne zhruba na 8,5. Také CT se mění v závislosti na pH. Okyselujeme li roztok, převádíme tím tak HCO3- na volný CO2, který při dosažení vyšší hodnoty parciálního tlaku než ve vzduchu, přechází z roztoku do atmosféry. CT závisí dále na alkalitě roztoku definované jako:
TA=[ HCO3-]+2[CO32-]+[OH-]-[H+]
Z těchto důvodů se CT ve sladkých vodách velmi liší a v přírodě vesměs závisí na minerálním složení podloží. Horská jezera s kyselým podloží mají nízkou alkalitu a nízké pH, v těchto podmínkách převažuje volný CO2 Koncentrace celkového uhlíku odpovídá zhruba koncentraci volného CO2 při rovnováze se vzduchem, tedy přibližně 16 µmol.l-1 při 15 °C. Naopak ve vápencových oblastech mají vody vysokou alkalitu a koncentrace hydrogenuhličitanu dosahuje desítek mmol.l-1. V třeboňských rybnících se hodnota CT obvykle pohybuje kolem 1-2 mmol.l-1. Tedy velmi rozmanité hodnoty. Naopak v mořích je koncentrace anorganického uhlíku poměrně vyrovnaná, okolo 2 mmol.l-1. (Knoppová) I přes značné výkyvy CT, se koncentrace CO2 v různých přírodních vodách příliš neliší, ale koncentrace hydrogenuhličitanu je velmi rozdílná. Obvykle je koncentrace hydrogenuhličitanu 50-100krát vyšší než CO2 a tak je uhličitanová tvrdost spolu s pH nejdůležitějším faktorem chemismu vody pro růst ponořených rostlin. (pH pro rostliny není důležité přímo, ale ovlivňuje množství volného CO2 viz výše) Životní procesy vodních organismů mohou zásadně a rychle měnit chemismus vody a tím zpětnou vazbou ovlivňovat druhovou diverzitu. Proto je obtížné rozhodnout, zda ponořené rostliny vytvářejí své prostředí, nebo zda prostředí určuje přítomné společenstvo. (Westlake 1971)
3. Měření obsahu CO2
Omlouvám se, tato část je zatím nejméně propracovaná. Bohužel sem na základce na chemii nedával pozor a mnohé by tu chtělo lépe rozebrat a vysvětlit. Hlavně domácí měření a výroba činidel a rozepsání logaritmických rovnic a vztahů v uhličitanovém systému a měření CO2 na jejich základě.
Měření koncentrace CO2 se provádí na základě pufračního systému. Je několik způsobů, složitější i snadné. Ovšem pro naše účely pouze orientační a slouží spíše pro kontrolu či sledování trendu. Nejčastěji se v akvaristické praxi používá pro zjištění orientačního obsahu CO2 tzv. Tillmanova tabulka. Na jejím základě fungují např. permanentní činidla na sledování koncentrace CO2. Prvně je potřeba zjistit kyselinovou neutralizační kapacitu (KNK) a pH. KNK se zjišťuje titrací HCl do pH 4,5, tj. do bodu, kdy je vyčerpána veškerá schopnost vody pufrovat změny pH a všechen hydrogenuhličitan je přeměněn na CO2. Stejně jako pro zjištění pH, i na KNK jsou v akvaristikách k dispozici testy. Z těchto hodnot v Tillmanově tabulce zjistíme obsah volného CO2.
Dalším způsobem je zjištění tzv. zásadité neutralizační kapacity (ZNK) fungující na stejném principu. Provádí se přidáváním NaOH dokud stačí voda pufrovat a nedosáhne pH 8,3. Při této titraci vznikají následující rovnice:
H2CO3 + NaOH = NaHCO3 + H2O
NaHCO3 + NaOH = Na2CO3 + H2O
Tyto reakce končí, až se dosáhne pH 8,3 a všechen volný CO2 se přemění na CO32-.
Oba způsoby mají své omezení a nemůžeme je použít ve vodě, kde není jediným prvkem ovlivňující pH hydrogenuhličitanový systém.
4. Úprava obsahu CO2
Jelikož se ve vodě (destilované) z atmosféry přirozeně dokáže rozpustit pouze 0,4-0,7 mg/l. tak nám v praxi vždy jde o zvýšení koncentrace oxidu uhličitého. Naskýtá se nám několik způsobů.
- Narušení rovnováhy pufračního schopnosti k volnému CO2. Tímto způsobem se sice nezvýší množství anorganického uhlíku ve vodě, ale zlepší se jeho dostupnost pro rostliny (všechny rostliny). Znamená to snížit pH jakýmkoliv způsobem (kyselinami, rašelinou ..,). Snižujeme tím znatelně KNK a tím naopak snižujeme CT. Tímto způsobem se nedá zvýšit koncentrace volného CO2 nad koncentraci odpovídající přirozené schopnosti vody ho udržet. Pokud se sníží pH jiným způsobem než pomocí hydrogenuhličitanového pufračního systému, nemáme v budoucnu možnost zjistit koncentraci volného CO2, protože veškeré možné testy fungují na zjištění KNK. Při snižování pH kyselinami, např. HCl vzniká následující rovnice
HCl = H+ + Cl- (kyselina ve vodě disociuje; přitom dojde k poklesu pH)
H+ + HCO3- = H2CO3 (pH se vrací na původní úroveň, ale alkalita se snižuje!)
- Umělé dosycování CO2. Tento způsob je pro akvária nejvhodnější a přitom velmi jednoduchý. Provádí se nejrůznějšími způsoby od podomácku vyrobenými nádoby s nejrůznějšími náplni až po profi vybavení. Ovšem je tu i riziko otrav ryb a ostatních živočichů.
- Zvýšením alkality – Přidáním hydrogenuhličitanů – sice se zároveň zvyšuje pH, ale zároveň se zvyšuje i množství anorganického uhlíku. Alkalitu můžeme zvýšit např. přidáním jedlé sody (NaHCO3) – jedna čajová lžička (6 g) na 50 l zvýší alkalitu asi o 4 dKH. Je to vhodné pro druhy rostlin, které je dokáží z vody získávat, protože některé toho schopny nejsou.
Není možné jednorázově trvale předávkovat vodu uhlíkem, celý uhličitanový systém je dynamický a otevřený. Nadbytečný uhlík ve formě CO2 z vody vyprchá, příliš velké množství HCO3- posune pH nad 8,3, kdy už ve vodě není přítomný volný CO2, ale vstupuje do hry rovnováha hydrogenuhličitany/uhličitany a nadbytečný uhličitan se sráží v nerozpustný uhličitan vápenatý. Jak tedy zajistit dostatečně kvalitní výživu oxidem uhličitým? Jsou dvě cesty. Mít v nádrži vyváženou produkci a spotřebu. Toho se docílí vyváženým osvětlením s dekompozičnými procesy při kterých se uvolňuje CO2 a dýcháním ryb. Tímto způsobem se ovšem růst rostlin nezvyšuje, ale rostliny jsou zdravé.
Druhý způsob zajistí rychlý růst rostlin a tím pádem i vysokou konkurenční schopnost proti případným řasám. Ovšem při silném osvětlení rostliny mohou růst tak rychle, že je nutné i jiné hnojení. Ale dává nám další možnost aktivně upravovat další parametr vody.
5. Dávkování CO2
Nejčastěji se s dávkováním CO2 začíná pomocí tzv. kvasničovače či burčáku. Jedná se o velice jednoduše vyrobenou aparaturu z následujících surovin.
- 1,5-2 l PET láhev
- vzduchovací hadička, délka podle potřeby
- (doplňky) spojka, rozdvojka, zpětný ventil na vzduchovací hadičky
- silikon či lepidlo na slepení víčka z PET lahve a hadičky (není nezbytností)
- ostrý a špičatý nůž
- difuzér
- náplň – hrnek cukru (200-300 g)
1 ml kvasnic (doporučuji sušené, ty zde budu také uvádět)
1-1,5 l vody
Na internetu je desítky, možná stovky nejrůznějších návodů a fantazie se při této výrobě nemusí omezovat, proto nebudu příliš rozepisovat. Nejprve si připravte vhodnou láhev. Nejvíce používám lahev 2l.
Dále se dá postupovat několika způsoby, od nejjednoduššího, po opravdu hodně propracované. Některé zde zmíním, navazují na sebe.
Do víčka lahve provrtejte otvor o něco menší, než je vzduchovací hadička. Tu pak tímto otvorem provlečte. Pokud budete dostatečně precizní, dírka bude natolik těsná, že nebude potřeba utěsnění lepidlem či akvarijním silikonem (ale utěsnění doporučuji a při další úpravě je to nutnost). Také je možné místo provlečení hadičky provléct spojku na spojování vzduchovacích hadiček, kterou už je vhodné přilepit a až na tuto spojku nasazovat hadičkou.
Možné doplňky. Po provedení předchozího postupu pokračujte přidáním zpětného ventilu. (dobrá věcička při použitím jako difuzéru filtru, který vytváří tlak a při každém vypnutí filtru a změně tlaku v láhvi je do lahve vehnáno množství vody. A v neposlední řadě, při špatné těsnosti či převrácení lahve je možný únik akvarijní vody.) Mezi zpětný ventil a láhev se dá vložit rozdvojka se škrtítkem a tím se dá regulovat množství CO2 vháněného do akvária. Ovšem je zde riziko přílišného přiškrcení a takového natlakováním láhve, že až exploduje. Dále je vhodné napojení soustavy na počítadlo bublin, které se vyrobí pomocí nádoby z části naplněné vodou, do které zespodu ústí hadička z láhve ukončená částí injekční jehly. Či za použití zpětného ventilu na který se nasadí injekční stříkačka s vodou. Z počítadla bublin už vede hadička přímo do difuzéru v akváriu.
Difuzér je ta nejdůležitější a nejproblematičtější věc. Zmíním jen některé varianty.
Nejjednodušší je použití vzduchovacího kamínku. S trochou štěstí se vám do ruky dostane, který vytváří malé bublinky a nepodchází. Ovšem záleží docela na štěstí. Velmi často se používá cigaretový filtr či lipové dřívko. Dřívka či filtru vezměte jen kousek o něco větších, než je hadička. Hadičku roztáhněte tužkou s pomocí nahřátí ohněm, vsuňte difuzér a opět ohněm trošku zatavte. (dřívko vsuňte léty podél, ne napříč) Dají se sehnat i komerční difuzéry např. tzv. žebřík fungující na principu procházení bublinky CO2 skleněnou kapilárou. Dále je možné vývod CO2 vsunout do vývodu filtru či sání. Do vývodu filtru se dají nainstalovat i různé propracovanější difuzéry. Mějte na paměti, že čím jsou menší bublinky (mají větší povrch, přes které může CO2 difundovat do vody), déle se vodě zdrží, nebo se rozpouštějí pod větším tlakem, tím je difuzér účinnější.
Náplň je základní věc každého kvasničovače, má jednoduchý recept, ale je to trochu alchymie. Jejím základem je cca 250 g cukru, 1 ml kvasnic (nejlépe sušených) a 1 l vody. Poměr kvasnic a cukru určuje rychlost a trvání reakce. Množství vody zde není příliš důležité, ale v průběhu reakce se hromadí alkohol, který následně reakci zastavuje, i když je cukru dostatek. Proto uvádím na začátek pouze 1 l vody. Při poklesu reakce, se po dolití vody koncentrace alkoholu zředí a reakce pokračuje dále. Takto namíchaná směs začne naplno reagovat nejčastěji až druhý den. Tento čas lze skráti použitím vlažné vody a ponecháním na teplém místě. Výtěžek CO2 je poměrně značný a jeho využití v akváriu záleží na účinnosti difuzéru. I pro nejmenší akvária je tento poměr poměrně bezpečný a zároveň dostačuje i pro akvária běžně zarostlá a osvícená o objemu více jak 200 l, ale je to velmi orientační a dovedu si představit i 50 l akvária, kde by produkce této náplně byla nedostatečná. Při nedostatečném bubláním tímto způsobem do větších nádrží doporučuji spíše více nádob než jednu velkou. Více nádob se lépe kontroluje a při časově rozdílném namícháním je stabilnější přidávání.
Mějte na paměti, že je ze začátku dávkování nutné znát aspoň orientační parametry vody (KNK a pH) a KNK je nutné hlídat. Může dojít ke snížení alkality a rychlému a znatelnému snížení pH. Dávkování CO2 se doporučuje až pro vody mající KNK více jak 4 °N.
A jak si s tím rostliny poradí? O tom zase někdy příště.
Použitá literatura
KNOPPOVÁ J.(1994): Adaptace vodních rostlin na nedostatek oxidu uhličitého ve vodě. - Biologické listy 59(4): 264-281.
Lellak J. & Kubíček K. (1991): Hydrobiologie. – Univerzita Karlova, Praha: 256 s.
Pitter P. (2009): Hydrochemie. - VŠCHT Praha
Za správnost informací zodpovídá autor článku, dotazy směřujte na autora. Hodnocení článku hvězdičkami provádí redakce. K článku se vyjádřete pomocí palců (líbilo se / nelíbilo se).
Líbilo se: 85x • Nelíbilo se: 2x • Zveřejněno: 27.02.2011 • Upraveno: 27.02.2011 • Přečteno: 5210x
Schválili: alpaka ![]()
![]()
![]()
![]()
![]() 30.11.12 • Bob66
30.11.12 • Bob66 ![]()
![]()
![]()
![]()
![]() 13.01.13
13.01.13
Související články
| Žádné související články |
Další články z rubriky Voda
| 03.06.2006 | Teplota, tvrdost a úprava vody | 31543x | |
| 23.08.2015 | Výroba skladovacího roztoku KCl na pH sondy | 918x | |
| 17.02.2011 | Problémy s vodou aneb jak mě jednoduchý akva test vody zachránil před možnými zdravotnímy problémy | 2081x | |
| 03.06.2006 | Zákaly vody | 24965x | |
| 21.02.2022 | Proč, čím a jak testovat vodu v akváriu | 372x | |
| 02.10.2018 | Jak na čistou a zdravou vodu v akváriu | 1156x | |
| 22.09.2011 | Kalibrace pro testy NO3 a PO4 - Referencni roztok. | 595x | |
| 28.09.2011 | Příprava standardních roztoků pro stanovení NO3, NO2, P | 1052x | |
| 09.12.2011 | Voda pro neplavce a mírně pokročilé | 883x | |
| 13.08.2010 | Jak určit pH - návod pro barvoslepé | 4389x |
Komentáře návštěvníků
![]() Funkce je dostupná pouze pro přihlášené uživatele
Funkce je dostupná pouze pro přihlášené uživatele
Další články tohoto autora
| 30.12.2023 | Malý atlas mechů | 2807x | |
| 08.12.2013 | Jak začít s akvaristikou | 15477x | |
| 09.02.2013 | Po letech na výstavě v HK (2013) (část 2) | 559x | |
| 09.02.2013 | Po letech na výstavě v HK (2013) (část 1) | 659x | |
| 29.12.2012 | Řasy a podobné organismy v akváriu | 23092x | |
| 26.07.2012 | Okřehek v akváriu | 2778x |